质量有话说丨合格的手术衣应该满足哪些测试要求
 发布时间:2022-10-14
发布时间:2022-10-14 作者:
作者: 浏览次数:5146
浏览次数:5146 点击分享
点击分享 9月23号,国家医疗器械监督抽检结果的通告(第3号)(2022年第45号)发布。国家药品监督管理局组织对手术衣等12个品种进行了产品质量监督抽检,发现26批(台)产品不符合标准规定,其中手术衣共计3个批次不符合,这无疑给广大手术衣生产和销售企业敲醒了警钟!
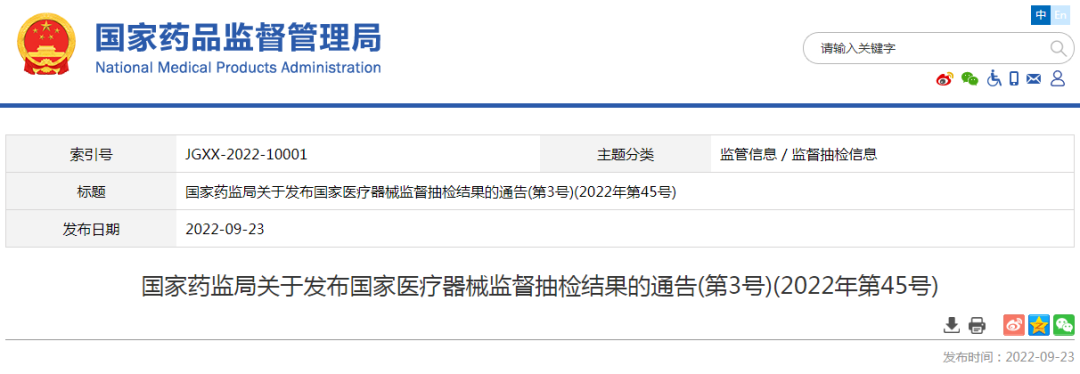
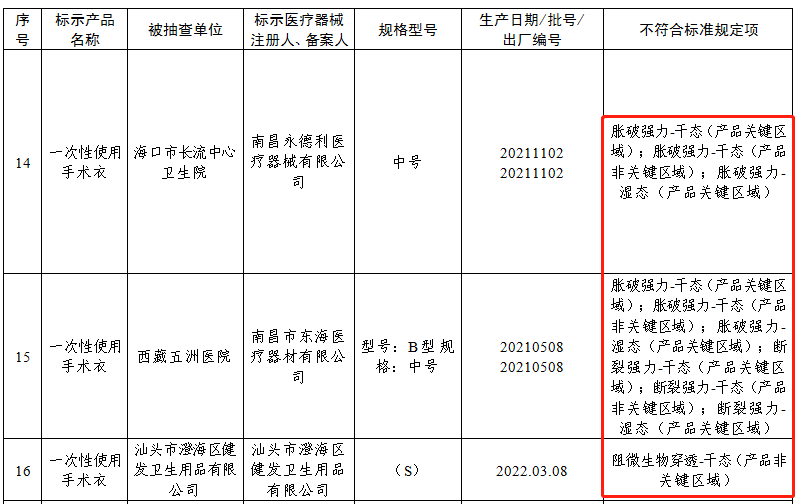
对于手术衣,大家可能既熟悉又陌生,但一款合格的手术衣应该满足哪些性能指标要求、评价依据标准是什么、不同国家地区的要求有什么差异,您是否了解呢?
总体来说,手术衣的相关测试主要包括三方面:性能要求、生物相容性测试、其他要求。
一、性能要求
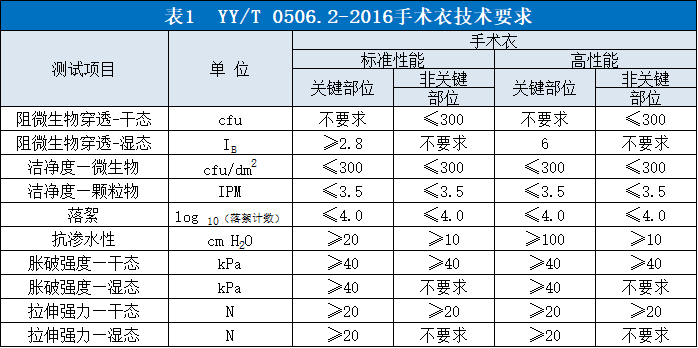
1.国内标准
我国关于手术衣的标准主要是YY/T 0506《病人、医护人员和器械用手术单、手术衣和洁净服》系列,共含8个部分,该系列标准参照欧盟标准EN 13795系列进行修改和制定。
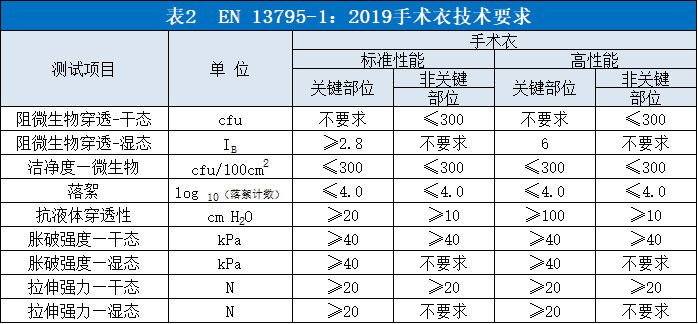
2.欧盟标准
欧盟手术衣适用标准为EN 13795-1:2019《手术服和手术单要求和测试方法 第1部分:手术衣和手术单》,该标准规定了手术衣的各项性能指标。
3.美国标准
美国材料试验协会于2020年发布ASTM F2407-2020《医疗设施用外科手术服的标准规范》当中对于医用领域用手术衣的力学性能、阻隔性能、落絮、透湿、耐磨等进行了规定。
其中阻隔性能依据的是美国医疗器械促进协会 AAMI于2012年发布的修订版AAMI PB70:2012,适用于一次性和重复性的手术衣,该标准依据液体阻隔性能将手术衣分为四级, 并对每一级的手术衣有不同指标要求。

注1:对于无菌型一次性手术衣,需要进行环氧乙烷灭菌验证,对于重复性手术衣,除了灭菌验证,还需要进行重复性验证。
注2:手术衣的有效期验证参照包装要求的有效期验证。
二、生物相容性测试
手术衣与完整皮肤接触,一般需进行细胞毒性、致敏(迟发性超敏反应)、皮肤刺激3项测试。ISO 10993系列标准是国际上医疗器械生物学评价的通用标准,国内对应的是GB/T 16886系列标准。
三、其他要求
1. 有效期验证
医疗器械有效期验证通常可分为加速稳定性试验和实时稳定性试验两类。实时稳定性试验周期较长,通常采用加速稳定性试验进行有效期的验证。
国内加速稳定性试验按YY/T 0681.1-2018《无菌医疗器械包装试验方法 第1部分:加速老化试验指南》执行。对应的美国标准则是ASTM F1980-2021 《无菌医疗器械屏障系统 加速老化试验指南》。
2. 包装验证
对于无菌的一次性手术衣,需要对产品包装性能进行验证。不同类型的包装需要根据实际选择包装验证试验。
国内包装验证按YY/T 0681无菌医疗器械包装试验方法系列执行,测试项目包括:稳定性试验、包装完整性、密封强度、染料渗透、粗大泄露(气泡法)、生物学屏障。
3. 模拟运输验证
对于无菌的一次性手术衣,还需要模拟运输验证,以确保产品在运输过程中不会出现包装破损导致产品性能变化等现象。
综上,相信大家对一款合格的手术衣应该满足哪些测试要求已经有了初步概念。
目前广检集团已获批药监医用纺织防护产品质量研究与评价重点实验室和广东省医用纺织防护产品科技成果转化基地,手术衣产品的检测能力齐全,已授权标准覆盖国标、欧标、美标,检测产品类别涵括手术衣、隔离衣、防护服、口罩、防护眼镜、医用帽、鞋套、手套等。
欢迎广大企业朋友咨询和交流!
送检咨询:020-61994598 020-61994599
地址:广州市番禺区珠江路1号
推荐新闻
您对口罩“过滤效率”了解吗?
发布时间:2022-06-06
质量有话说,纺织品消臭性能的测试与评价
发布时间:2022-06-10
质量有话说 服装及鞋袜国际RSL管理(AFIRM)介绍
发布时间:2022-07-11
国际“召”闻 | 5月全球主要市场服装召回情况
发布时间:2022-06-15
广检大数据丨618质量消费提示
发布时间:2022-06-17
国际“召”闻丨6月全球主要市场服装召回情况
发布时间:2022-07-01
羽绒服装新标准重要变化
发布时间:2022-07-25
质量有话说丨电商日常质量管理
发布时间:2022-08-17
质量有话说——三月倒春寒 2022羽绒服装最新选购指南
发布时间:2022-03-03
质量有话说|如何看懂E12、H13、H14级空气过滤材料检测报告
发布时间:2022-05-12
质量有话说丨纺织品防蚊性能的检测和评价
发布时间:2022-09-01
质量有话说丨鞋类产品标识要求
发布时间:2022-09-16
质量有话说丨你的毛巾可能比“抹布”还脏?传统毛巾的替代品来了!
发布时间:2022-09-20
质量有话说丨衣物勾丝正常吗?
发布时间:2022-11-07
质量有话说丨掉毛的控制与应对
发布时间:2022-11-21
国际“召”闻|1月全球主要市场服装召回情况
发布时间:2023-02-16
回南天即将上线|如何正确开启“防霉防潮”模式?
发布时间:2023-03-01
质量有话说|荧光增白剂的正确认识——一只会发光的水母引发的思考
发布时间:2023-03-22
质量有话说|校服光汗褪色成因及解决方法
发布时间:2023-03-22
质量有话说丨生活中化学物质无处不在,PFAS您了解吗?
发布时间:2023-04-25
国际“召”闻丨5月全球主要市场服装召回情况
发布时间:2023-06-13
入秋天凉,增添衣物 | 秋冬选衣需关注哪些项目?
发布时间:2023-10-31
小检科普|太阳镜的颜色有什么作用
发布时间:2023-10-20
国际“召”闻 | 9月全球主要市场服装召回情况
发布时间:2023-10-13
国际“召”闻 | 10月全球主要市场服装召回情况
发布时间:2023-11-10
轻暖过冬 | 羽绒被如何选购?看完这篇就够了
发布时间:2023-11-30
健康生活,舒适睡眠|关于床垫你了解多少?
发布时间:2023-11-23
小检科普|消臭纺织品是如何消臭的?
发布时间:2024-04-11
秋冬干燥,纺织品静电问题解决方案
发布时间:2025-02-10
玩具卖家必看:亚马逊重磅新规落地!如何合规高效出海?
发布时间:2025-08-29



















